
Les batteries Ni-MH ont conquis de nombreuses part de marché en substitution aux piles alcalines, ainsi que pour les premières voitures hybrides. Voyons comme le nickel et l’hydrogène agissent ensemble, avec des alliages de terres rares, pour stocker l’énergie.
Les batteries Ni-MH, pour « Nickel-Hydrure Métallique », ont équipé un grand nombre d’applications dites « portables », plus connues du grand public par le nom « piles rechargeables ». Leurs ventes ont en outre été soutenues lorsqu’elles ont remplacé les batteries Nickel-Cadmium (NiCd), après leur interdiction en 2006 par la « Battery Directive » de l’Union européenne (2006/66/EC), pour les applications non industrielles. Par ailleurs, de nombreux véhicules hybrides ont été équipés de batteries Ni-MH, par exemple, l’emblématique Prius de Toyota.
La technologie n’est pas récente. Elle a été inventée en 1967 à l’Institut Battelle de Genève, un centre de recherche du Battelle Memorial Institute étasunien. Développée au cours des décennies suivantes, elle a été mise sur le marché à partir des années 1990. Elle est toutefois supplantée aujourd’hui par la technologie Li-Ion, ces dernières devenant graduellement plus performantes.
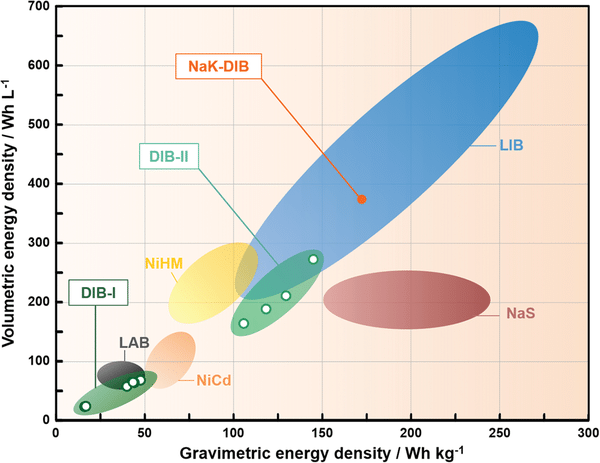
L’énergie spécifique d’une batterie Ni-MH est en effet de l’ordre de 60 – 120 Wh/kg, tandis que son énergie volumique est de l’ordre de 150 – 300 Wh/L (voir illustration ci-dessous). Pour les accumulateurs Li-ion, les valeurs sont de l’ordre de 100 à plus de 250 Wh/kg pour l’énergie spécifique, et de 250 à près de 700 Wh/L pour l’énergie volumique. Ces différences expliquent le fait que les batteries Ni-MH ont été progressivement remplacés dans les applications de mobilité, même s’il reste des véhicules équipés en Ni-MH comme l’Highlander Hybride de Toyota.
Les batteries Ni-MH restent toutefois moins coûteuses que les batteries Li-ion. Même si elles utilisent du nickel, un élément aujourd’hui recherché, elles peuvent être en outre une alternative au lithium. Enfin, elles n’utilisent pas de cobalt, qui peut s’avérer difficile à approvisionner et pose des enjeux humains et environnementaux, ni de cadmium, dont le relâchement accidentel peut conduire à des problèmes graves pour la santé humaine et l’environnement.
Une batterie Ni-MH est un ensemble de cellules encloses dans une enveloppe de protection. Chaque cellule contient un accumulateur, qui est le composant même où est stockée l’énergie. Dans le cas d’un accumulateur Ni-MH, deux électrodes sont placées dans un bain constitué d’un électrolyte liquide ; l’électrode positive est constituée de nickel (Ni) et l’électrode négative est constituée d’un hydrure métallique (MH).
Ce dernier est un métal, ou plus généralement un alliage de métaux, qui est capable de former un composé spécifique avec l’hydrogène, appelé hydrure, et dont la fonction est de servir de stock d’hydrogène. Ces alliages peuvent être un mélange de terres rares (comme le lanthane, le cérium, le néodyme ou le praséodyme) avec un élément intermétallique (comme le nickel, le cobalt, le manganèse ou l’aluminium). Il existe également des alliages de titane ou du vanadium, avec d’autres métaux comme le zirconium ou le nickel.
À lire aussiL’empreinte écologique des batteries : rumeurs et réalitésL’électrolyte est généralement constitué d’hydroxyde de potassium KOH dilué. Dans l’eau, l’hydroxyde de potassium KOH se dissout, et forme un mélange d’ions potassium positifs K+, d’ions hydroxyde négatifs OH– et de molécules d’eau H2O. Ce mélange est très conducteur d’électricité.h
Un accumulateur Ni-MH stocke l’électricité sous une forme chimique, ce qui signifie que le processus de charge / décharge va mettre en jeu des réactions chimiques conduisant plusieurs éléments à interagir entre eux : hydrogène (H), oxygène (O), nickel (Ni) et l’alliage de métaux divers qui constitue l’électrode négative. De ce fait, un accumulateur Ni-MH entre dans la catégorie dite des « accumulateurs électrochimiques », laquelle regroupe la très grande majorité des systèmes de stockage d’électricité de la vie courante.
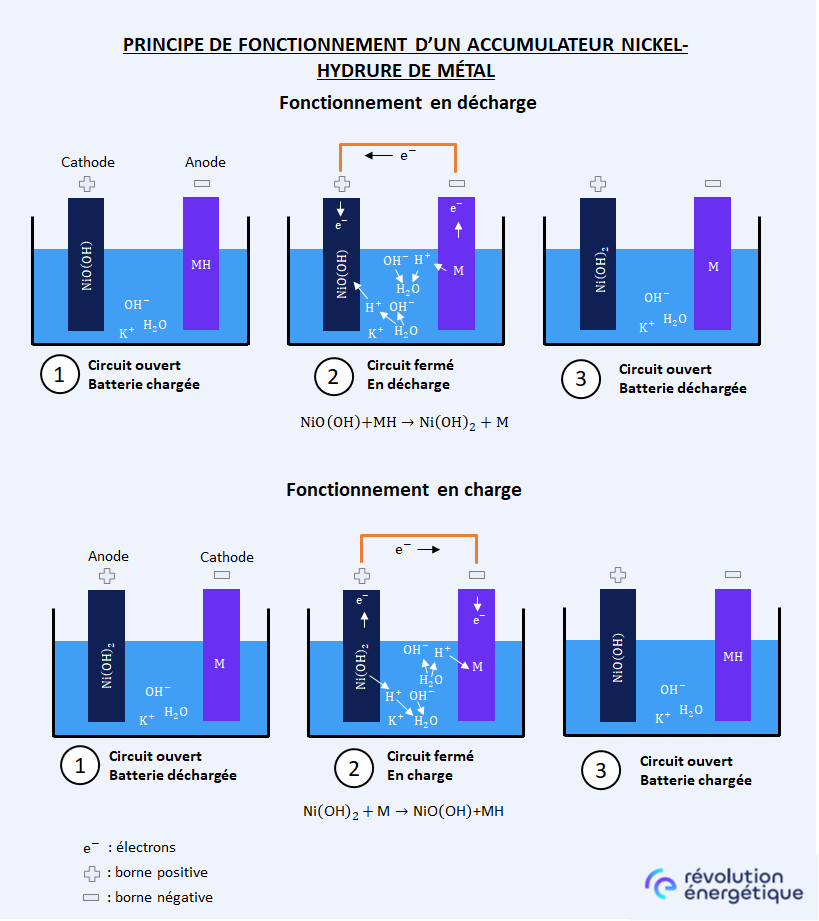
Lors de la décharge de l’accumulateur, ce dernier est une source d’énergie, les réactions chimiques sont donc spontanées. Pour ce faire, il faut connecter l’électrode positive avec l’électrode négative par un circuit électrique extérieur, relié aux appareils que l’on cherche à alimenter en électricité. L’électrolyte permet de transmettre le courant à l’intérieur de la batterie. Le circuit électrique global est donc fermé, permettant la circulation du courant.
Au cours de la décharge, au niveau de l’électrode négative, l’hydrure métallique (HM) situé dans l’électrode négative réagit avec l’ion hydroxyde OH– contenu dans l’électrolyte. Cette réaction va conduire à extraire l’hydrogène de l’hydrure, qui va se lier avec l’OH– de l’électrolyte pour former de l’eau. Il restera dans l’électrode négative du métal (M) à l’état natif. La réaction va également produire un électron, qui va circuler au travers du circuit externe, depuis l’électrode négative jusqu’à l’électrode positive.
À lire aussiCe système de stockage mélange de vieilles batteries au plomb, lithium et NiMH de voitures électriquesAu niveau de l’électrode positive, l’oxyhydroxyde de nickel NiO(OH), de niveau d’oxydation +III, va être réduit par l’eau et consommer l’électron, pour former d’une part de l’hydroxyde de Ni(OH)2, de niveau d’oxydation +II, et d’autre part un ion OH– dans l’électrolyte. La circulation des ions OH-, consommés au niveau de l’électrode négative et produits au niveau de l’électrode positive, va conduire à la circulation du courant électrique à l’intérieur de l’accumulateur.
Au cours de la charge, les réactions sont inversées. L’électrode négative, constituée de l’alliage métallique (M), à l’état natif et sans hydrogène, va consommer un électron pour réduire l’eau, c’est-à-dire pour en extraire un atome d’hydrogène qu’elle va intégrer dans sa structure sous forme d’hydrure métallique (HM). Cette réaction va produire un ion OH–.
Au niveau de l’électrode positive, le Ni(OH)2, à l’état d’oxydation +II, va être oxydé : il va libérer un ion H+, et former du NiO(OH), à l’état d’oxydation +III ; cette réaction va produire un électron qui va circuler au travers du circuit externe, depuis l’électrode positive jusqu’à l’électrode négative. L’hydrogène libéré par l’électrode positive va consommer un ion OH–, pour former de l’eau. La circulation des ions OH–, produits à l’électrode négative et consommés à l’électrode positive, va conduire à la circulation du courant à l’intérieur de l’accumulateur.
La suite de votre contenu après cette annonce
Notre Newsletter
Ne ratez plus les dernières actualités énergetiques
S'inscrire gratuitement