
Les batteries Li-ion sont devenues omniprésentes dans notre vie quotidienne : elles équipent nos téléphones et ordinateurs portables, nos outils sans fil, les drones, et sont utilisées également dans les voitures électriques. Découvrez comment le lithium permet de stocker de l’énergie.
Les batteries Li-ion ont été inventées au cours des années 1960, mais elles n’ont été commercialisées en masse qu’à partir des années 1990, à l’issue d’un long processus de développement technologique. Cette longue période de maturation a été nécessaire pour inventer les meilleures techniques, notamment les bons choix de matériaux, afin de réduire les risques d’auto-inflammation de la batterie : le lithium est en effet très réactif avec l’eau ou avec l’air. Ces inventions ont été jugées suffisamment importantes pour amener le Comité Nobel à attribuer, en 2019, le Prix Nobel de Chimie, à John B. Goodenough, Stanley Whittingham et Akira Yoshino pour leurs efforts concernant le développement des accumulateurs Li-ion.
À lire aussiComment fonctionne une batterie plomb-acide ?Une batterie lithium-ion, ou appelée plus simplement Li-ion, est un ensemble de cellules encloses dans une enveloppe de protection. Chaque cellule contient un accumulateur, qui est le composant même où est stockée l’énergie. Un accumulateur est constitué d’une électrode positive et d’une électrode négative entre lesquelles est intercalé un séparateur, dont la fonction est d’éviter les courts-circuits entre les deux électrodes. L’ensemble est immergé dans un électrolyte.
Cellules lithium-ion et batterie de l’Hyundai Kona électrique 64 kWh / Images : Automobile Propre – SB, HL.
Dans la grande majorité des cas, l’électrode négative est constituée de graphite, qui se présente sous la forme de feuillets. L’électrode positive, quant à elle, est constituée d’un oxyde d’un métal de transition, dont la structure cristalline forme également des feuillets, typiquement de l’oxyde de cobalt. Cette structure en feuillet, qui est commune aux deux électrodes, a la particularité de pouvoir contenir des atomes de lithium entre ses feuilles. Dans le cas du graphite, la présence de lithium conduit à former un composé d’insertion désigné par la formule LiC6 ; dans le cas du cobalt, il se forme un oxyde mixte de lithium et de cobalt, qui s’écrit LiCoO2, et est généralement désigné par LCO.
L’électrolyte est un sel de lithium dissous dans un solvant organique, par exemple un mélange de carbonate d’éthylène et de propylène. En effet, le lithium réagit fortement avec l’eau, cette dernière ne peut donc pas être utilisée comme solvant.
Un accumulateur Li-ion stocke l’électricité sous une forme chimique, ce qui signifie que le processus de charge / décharge va mettre en jeu des réactions chimiques conduisant plusieurs éléments à interagir entre eux : lithium (symbole chimique Li), cobalt (Co), oxygène (O) et carbone (C). De ce fait, un accumulateur Li-ion entre dans la catégorie dite des « accumulateurs électrochimiques », laquelle regroupe la très grande majorité des systèmes de stockage de l’électricité de la vie quotidienne.
À lire aussiComment fonctionne un panneau photovoltaïque ?Lors de la décharge de l’accumulateur, ce dernier est une source d’énergie, les réactions chimiques sont donc spontanées. Pour qu’elles se produisent, il faut connecter l’électrode positive avec l’électrode négative par un circuit électrique extérieur, contenant la charge que l’on cherche à alimenter en électricité. Les ions contenus dans l’électrolyte vont transmettre le courant à l’intérieur de la batterie, fermant ainsi le circuit et permettant la circulation des charges électriques.
Comme nous l’avons dit, les électrodes positive et négative sont toutes les deux constituées d’un matériau qui peut contenir du lithium. Toutefois, le matériau de l’électrode négative, dans notre exemple le LiC6, a une affinité moindre avec le lithium que le matériau de l’électrode positive, le LiCoO2. Ainsi, lorsqu’on ferme le circuit électrique avec un circuit extérieur, la réaction spontanée qui se produit est le transfert de lithium de l’électrode négative vers l’électrode positive, et c’est cette réaction qui constitue la source d’énergie, en quelque sorte le « moteur » de la mise en mouvement des électrons, lors de la décharge de l’accumulateur.
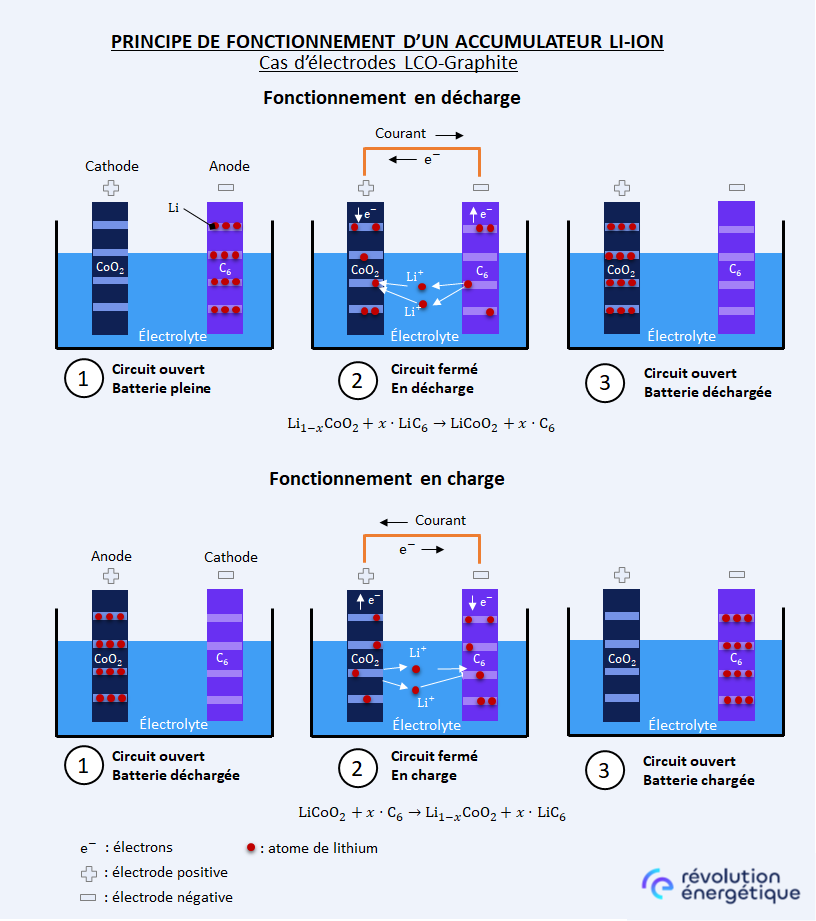
À l’électrode négative, se produit une réaction d’oxydation (l’électrode joue alors le rôle d’anode) du LiC6, qui conduit à extraire de la matrice graphite d’une part des ions lithium Li+, chargés positivement, et d’autre part des électrons e–, chargés négativement. Les ions Li+ se déplacent au sein de la batterie par le biais de l’électrolyte, de l’électrode négative vers l’électrode positive, tandis que les électrons quittent se déplacent dans le même sens, mais par le biais du circuit extérieur. Au niveau de l’électrode positive, se produit la réaction de réduction : les ions Li+ se recombinent avec les électrons et le LiCoO2.
Pour être tout à fait précis, il faut faire remarquer qu’à l’état chargé de la batterie, l’oxyde mixte LiCoO2 est dans un état dit « sous-stœchiométrique », c’est-à-dire qu’il lui manque du lithium pour être à l’équilibre. Dans cette situation, la formule chimique s’écrit Li1-xCoO2, le « -x » en indice du symbole « Li » traduisant ce manque. Le lithium extrait de l’électrode négative vient donc compléter ce manque. Lorsque plus aucun atome de lithium ne peut être extrait du graphite, il n’y a plus de source d’énergie, et la batterie est déchargée.
À noter que dans une batterie Li-ion, l’électrolyte et le circuit externe sont des milieux conducteurs uniquement, pour, respectivement, les ions lithium et les électrons ; les constituants de l’électrolyte ne participent pas à la réaction chimique, contrairement, par exemple, au cas d’un accumulateur plomb-acide.
À lire aussiComment fonctionne une station de transfert d’énergie par pompage (STEP) ?Lors de la charge, il se produit la réaction inverse. Sous l’effet de la tension appliquée aux bornes de l’accumulateur, le lithium va être extrait de l’oxyde mixte LiCoO2 de l’électrode positive – qui jouera cette fois le rôle d’anode. Cette réaction d’oxydation va conduire à produire des ions Li+, des électrons e–, et de l’oxyde sous-stœchiométrique Li1-xCoO2. Le lithium va se diriger vers l’électrode négative au travers de l’électrolyte, tandis que les électrons circuleront vers l’électrode négative par le circuit extérieur.
Au niveau de l’électrode négative, les ions lithium vont s’insérer dans les structures graphite pour former le composé d’insertion LiC6. C’est une réaction d’oxydation, faisant que l’électrode négative joue lors de la charge le rôle de cathode. La batterie sera complètement chargée lorsqu’il n’est plus possible d’extraire de lithium de l’oxyde mixte sous-stœchiométrique Li1-xCoO2.
La suite de votre contenu après cette annonce
Notre Newsletter
Ne ratez plus les dernières actualités énergetiques
S'inscrire gratuitement